 Denomina-se entalpia-padrão de dissolução a variação de entalpia (∆ H0) envolvida na dissolução de 1 mol de determinada substância numa quantidade de água suficiente para que a solução obtida seja diluída.
Denomina-se entalpia-padrão de dissolução a variação de entalpia (∆ H0) envolvida na dissolução de 1 mol de determinada substância numa quantidade de água suficiente para que a solução obtida seja diluída.O processo de dissolução de uma substância em água se dá em duas fases, cada uma envolvendo respectivamente um ∆ H1 e um ∆ H2, sendo que: ∆ H0 dissolução = ∆H1 + ∆H2.
1° .) Quebra das ligações interatômicas em compostos iônicos ou capazes de formar íons e intermoleculares em compostos covalentes. Esta fase é sempre endotérmica.
H2O
CxHy > Cy+(aq) + Ax-(aq) D H2 > 0
2° .) Hidratação das partículas (íons) do soluto. O envolvimento ordenado das moléculas de água ao redor das partículas (íons) do soluto é sempre um processo exotérmico.
Cy+ + Ax- + H2O à Cy+(aq) + Ax-(aq) ∆ H2 < 0
Assim, podemos concluir:
∆H0 dissolução > 0 se: D H1 > D H2
∆H0 dissolução <>D H1 < D H2
Entalpia-Padrão de Formação
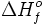 Denomina-se entalpia-padrão de formação a variação de entalpia ( H0f ) envolvida na reação de formação de 1 mol de moléculas de determinada substância, a partir de substâncias simples
Denomina-se entalpia-padrão de formação a variação de entalpia ( H0f ) envolvida na reação de formação de 1 mol de moléculas de determinada substância, a partir de substâncias simples 1 H2g ∆ 1 H2(g) ∆ H0f = 0,0 Kcal
1 O2(g) ∆ 1 O2(g) ∆ H0f = 0,0 Kcal
1 C(grafita) ∆
