Isótopos - Química Ambiental
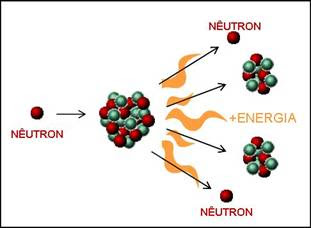
As bombas atômicas, cujo princípio se baseia nas gigantescas quantidades de energia desprendidas durante as reações de fissão nuclear, utilizam como matéria-prima o isótopo 235 do urânio. Isótopos são átomos de um mesmo elemento que diferem entre si quanto ao número de massa (quantidade de prótons e nêutrons no núcleo), motivo pelo qual apresentam propriedades físicas diferentes, mas comportamentos químicos semelhantes. Considerações gerais. De acordo com a teoria atômica proposta por John Dalton, no século XIX, e desenvolvida, ao longo do século XX, com o auxílio da mecânica quântica, os átomos possuem duas regiões com propriedades bem diferenciadas. A primeira delas é formada de um núcleo pequeno se comparado ao volume atômico, com elevada densidade eletrônica e constituída de partículas denominadas prótons (carregadas positivamente) e nêutrons (eletricamente neutros). A constituição do núcleo atômico confere a um elemento suas propriedades físicas específicas. O núcleo é envolvido por elétrons, partículas elementares de carga negativa, distribuídos em orbitais com níveis energéticos distintos. A configuração eletrônica confere ao elemento suas propriedades químicas particulares.
Um elemento é primeiramente identificado pelo número de prótons existentes em seu núcleo (número atômico), mas nem todos os átomos de um mesmo elemento apresentam o mesmo número de nêutrons. Essa variação é, precisamente, o que distingue os isótopos. História. A primeira evidência de que duas substâncias com as mesmas propriedades químicas não apresentam, obrigatoriamente, características físicas idênticas resultaram do estudo da radioatividade dos elementos pesados. Em 1906 e 1907, vários pesquisadores mostraram que a mistura de iônio e tório não podia ser separada por nenhum processo químico. Pelo critério da indistinguibilidade química, comprovou-se que a mistura era na verdade composta de duas espécies radioativas do mesmo elemento: tório 230 (iônio) e tório 232.
O termo isótopo foi criado em 1913 pelo químico inglês Frederick Soddy para designar as diferentes espécies do mesmo elemento. Pouco tempo depois, surgiram indicações de que a isotopia poderia existir também no grupo dos elementos estáveis. Em 1919, Francis Aston provou que o neônio consistia, principalmente, de duas espécies atômicas. Seguiu-se a descoberta de que o cloro tinha dois isótopos, e logo ficou claro que a maioria dos elementos consiste de uma mistura de isótopos. A invenção das pilhas atômicas para reações nucleares e dos aceleradores de partículas abriu a possibilidade de obter isótopos de quase todos os elementos químicos conhecidos. Na maioria dos casos, esses isótopos são artificiais e se desintegram espontaneamente, por processos radioativos, para dar origem a isótopos estáveis do mesmo elemento. Abundância isotópica. Na natureza, quase todos os elementos químicos presentes em substâncias minerais e na atmosfera são compostos de vários isótopos. O hidrogênio, por exemplo, o átomo mais simples do ponto de vista estrutural, apresenta-se com três isótopos distintos: o hidrogênio propriamente dito, de massa 1 uma (unidade de massa atômica), com abundância superior a 99%; o deutério, com 2 uma, constituinte da água pesada, empregada na refrigeração de reatores nucleares; e o trítio, com 3 uma, instável e radioativo. Entre os halogênios, o bromo é uma combinação praticamente eqüitativa de seus isótopos 79 e 81, enquanto o flúor apresenta uma única variedade isotópica. Os isótopos de urânio desempenham um papel fundamental em todos os processos nucleares e radioativos. De modo geral, para cada elemento, a proporção de isótopos é fixa, independentemente de seu estado físico.
Aplicações. Os isótopos têm inúmeras aplicações na medicina, na indústria e na pesquisa científica. O isótopos radioativos são comprovadamente eficazes como traçadores em alguns métodos de diagnósticos. Por serem quimicamente idênticos aos isótopos estáveis, tomam seu lugar nos processos fisiológicos e podem ser detectados com equipamentos como o espectrômetro de raios gama.
O iodo 131 se emprega para avaliar, por exemplo, a atividade da glândula tireóide, onde o isótopo se acumula. Usa-se o fósforo 32 para identificar tumores malignos, porque as células cancerosas tendem a acumular fosfatos em quantidade maior do que as células normais. Isótopos radioativos como o cobalto 60 e o césio 137 são usados no tratamento do câncer, para minimizar os prejuízos causados a células vizinhas aos tumores. Entre as aplicações industriais dos radioisótopos, a mais importante é a geração de energia a partir da fissão nuclear do urânio, nos reatores nucleares. Os isótopos radioativos também podem ser usados para medir a espessura de lâminas plásticas e metálicas e para induzir mutações genéticas em plantas, com a finalidade de obter espécies vegetais mais resistentes. A pesquisa geológica e arqueológica fez sensíveis progressos com a utilização de técnicas de datação radiométrica, principalmente com o carbono 14, que ajudou a reconstituir a seqüência de eventos pré-históricos e históricos e a determinar a idade de fósseis e restos arqueológicos.